Derivado de las acciones establecidas para dar continuidad a la implementación de e-Reporting Industria y los estándares MedDRA y WHODrug señaladas en la pasada publicación del 2 de mayo del 2022, se presenta el Plan de implementación de WHODrug para la industria farmacéutica (titulares de registros sanitarios o sus representantes legales en México, establecimientos donde se realice investigación para la salud, distribuidores y comercializadores).
WHODrug permitirá a la industria farmacéutica codificar los productos de investigación, medicamentos y vacunas de manera estandarizada favoreciendo el análisis de datos en ensayos clínicos y datos de seguridad pos comercialización;
El objetivo de este plan es definir las pautas que marcarán el proceso de implementación de WHODrug como diccionario único para la identificación de medicamentos y vacunas en los procesos de Farmacovigilancia, específicamente en la notificación tanto de Eventos Adversos (EA) en la etapa clínica como la notificación de Sospechas de Reacciones Adversas a Medicamentos (SRAM), Reacciones Adversas a Medicamentos (RAM), Eventos Supuestamente Atribuibles a la Vacunación o Inmunización (ESAVI) y otros problemas de seguridad relacionados al uso de medicamentos.
Los principales acontecimientos de la implementación se resumen a continuación.
- Enero 2023. Publicación del Manual de WHODrug para México
- Abril 2023. Foro de capacitación presencial de WHODrug en México
- Octubre 2023. 1er Usergroup WHODrug/MedDRA LATAM en México
- 1 Diciembre 2023. Descontinuación del formato E2B(R2)
- 1 Enero 2024. La industria farmacéutica deberá codificar medicamentos y vacunas con WHODrug en las notificaciones de EA, SRAM, RAM, ESAVI y cualquier otro problema de seguridad derivado de su uso, conforme a los lineamientos publicados
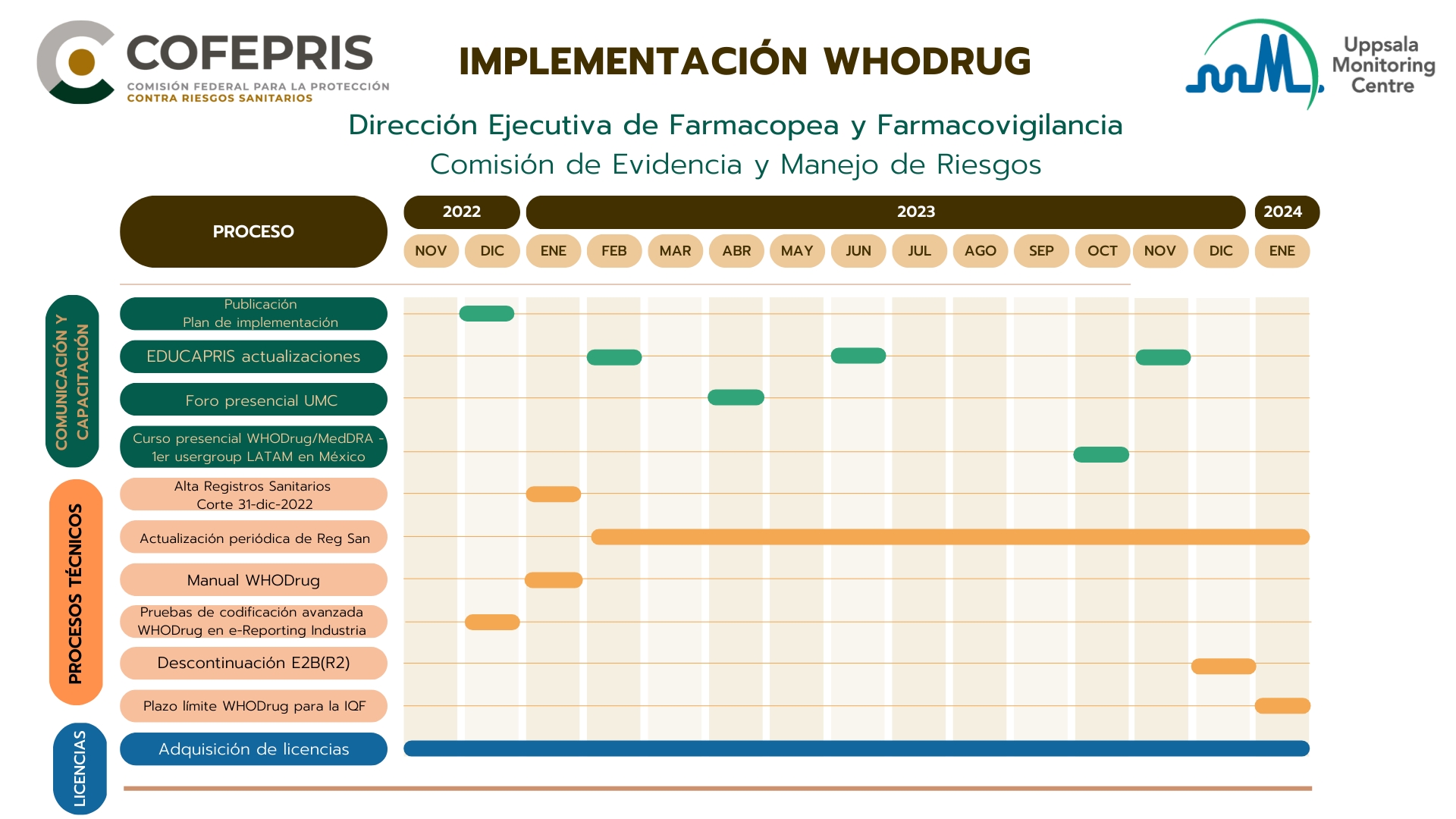
En el plan de implementación encontrará a detalle la descripción de todos los acontecimientos que conforma el proceso. Puede descargarlo en los siguientes enlaces.
- Plan de Implementación de WHODrug Versión 1.1 (Español)
- Plan de Implementación de WHODrug Versión 1.1 (Inglés)
- Guía técnica para el uso de WHODrug Global en XML cargados en VigiFlow eReporting para la Industria para el cumplimiento de E2B(R3) Versión 2.0 (español)
- Guía técnica para el uso de WHODrug Global en XML cargados en VigiFlow eReporting para la Industria para el cumplimiento de E2B(R3) Versión 2.0 (inglés)
- Cómo usar el formato WHODrug C3 para la codificación de medicamentos Versión 2.0 (Español)
- Cómo usar el formato WHODrug C3 para la codificación de medicamentos Versión 2.0 (Inglés)
- Cronograma de implementación WHODrug (Español)
- Cronograma de implementación WHODrug (Inglés)
Capacitación presencial WHODrug 2023
- Presentaciones:
- Implementación de WHODrug en México, justificación y puntos importantes
- WHODrug Global como estándar de codificación de medicamentos y vacunas
Puede consultar más información en los siguientes enlaces externos:
