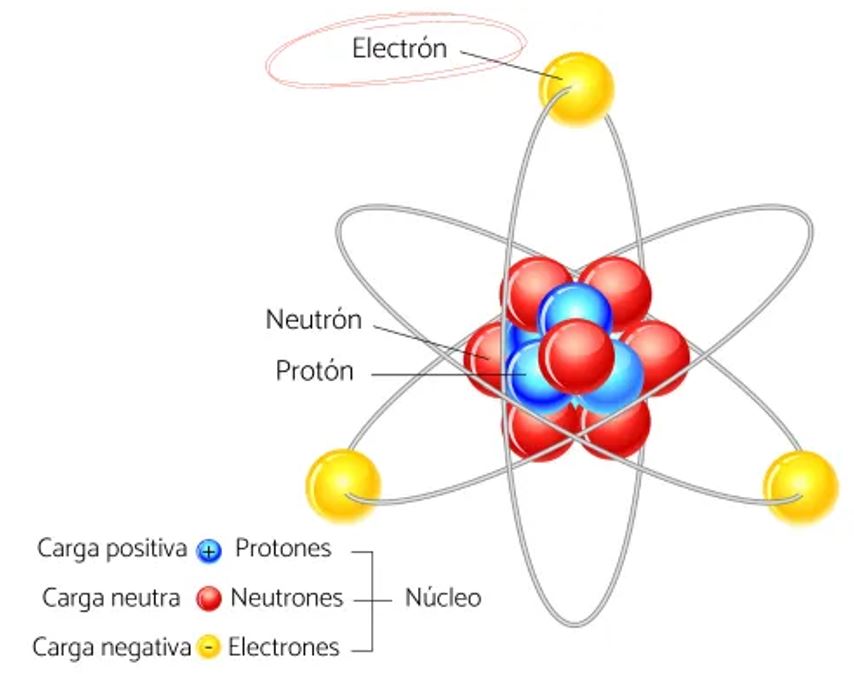
Hoy sabemos que los átomos no son indivisibles, sino que están formados por unas partículas subatómicas, llamadas partículas elementales. Estas se pueden definir como entes físicos más simples que el núcleo atómico, y se considera que son el último constituyente de la materia. Las tres partículas elementales que forman parte del átomo son: el electrón, el protón y el neutrón. (1)
El electrón es una partícula subatómica con carga negativa dispuesta en orbitales alrededor del núcleo atómico asegurando su estabilidad electromagnética. Los electrones son partículas en movimiento de difícil localización, de ahí que se hable de regiones de probabilidad. Se encuentran distribuidos en orbitales de diferentes niveles energéticos. Son responsables de las reacciones entre compuestos y del tipo de enlace químico.
Características de un electrón
Los electrones no pueden subdividirse en otras expresiones menores de materia. Según los avances de la mecánica cuántica, los electrones poseen niveles de energía cuantizados, dicho de otra forma, sólo pueden existir en determinaros valores de energía. Por lo tanto, se pueden definir en valores discretos a través de los números cuánticos. Estos permiten visualizar rápidamente algunas propiedades de los electrones.
Carga de un electrón
Los electrones son partículas de carga negativa de -1,6x10-19 C que se sienten atraídas por otras de carga opuesta como los protones. Al tratarse de partículas cargadas en movimiento, los electrones generan su propio campo magnético de forma que su fuerza es directamente proporcional a la velocidad. Como es previsible, el aumento de la carga eléctrica del electrón generará un campo magnético mayor. Las expresiones prácticas de la carga del electrón se manifiestan a través de fenómenos como la electricidad estática y la conductividad.
Masa de un electrón
Son partículas muy pequeñas con una masa inferior a la de protones y neutrones. De esta manera, la masa de un electrón es 9,11x10-31 kg. La teoría de la relatividad de Einstein permite relacionar la masa con la energía a tal punto que, a valores semejantes a la velocidad de la luz, una partícula puede variar su masa. Esta resolución, tiene importantes implicaciones en la energía nuclear y en la física cuántica, ya que permite obtener una considerable cantidad de energía con valores modestos de masa. Este fenómeno ocurre en elementos pesados como el berkelio, donde su elevada carga eléctrica permite a sus electrones alcanzar valores cercanos a 3x108 m/s. (2)
Joseph John Thompson y el descubrimiento del electrón
Thompson (1856-1940) nació en Cheetham Hill, cerca de Manchester. Era el hijo de un vendedor de libros. Cuando tenía 14 años entró al Owens College de Manchester, donde pudo asistir a varios cursos de física experimental. En 1876 obtuvo una beca para el Trinity College, en Cambridge, donde permanecería el resto de su vida. Después de graduarse en matemáticas en 1880, la oportunidad de hacer investigación experimental le atrajo al laboratorio Cavendish. Ayudó a revolucionar el conocimiento sobre la estructura del átomo con su descubrimiento del electrón. (3)
El 30 de abril de 1897, Thomson anunció el descubrimiento del electrón (aunque él no lo llamó así, lo llamó “corpúsculo”) en una conferencia impartida en la Royal Institution en Londres. En su discurso, en el que comunicaba sus resultados experimentales, demostraba la naturaleza corpuscular de los rayos catódicos.
El trabajo de Thomson revelaba que los rayos emitidos por un cátodo (o electrodo negativo) estaban compuestos por partículas de carga negativa, a las que el físico denominó “corpúsculos”. Su masa calculada era del orden de 1,000 veces menor que la de la unidad de carga más pequeña conocida entonces, el átomo de hidrógeno ionizado (H+).
Thomson había encontrado la primera partícula subatómica, pero en realidad no buscaba eso, sino una unidad de carga eléctrica, lo que el físico perseguía era “una comprensión de los mecanismos de interacción entre materia y electricidad”. J.J. Thomson recibió el Nobel en 1906 por su línea principal de trabajo, sus investigaciones en la conducción de la electricidad en tubos llenos de gas. (4)
__________________________________________________
Con investigación de: Claudio Fernández Ortega del Centro de Documentación y Divulgación Científica, del ININ.
REFERENCIAS
- Foro Nuclear (2024). ¿Qué son las partículas elementales? Recuperado el 8 de abril de 2024, de: https://www.foronuclear.org/descubre-la-energia-nuclear/preguntas-y-respuestas/sobre-fisica-nuclear/que-son-las-particulas-elementales/
- Munilla, Victoria (2023). Electrón: qué es, carga, masa y descubrimiento. Recuperado el 8 de abril de 2024, de: https://www.geoenciclopedia.com/electron-que-es-carga-masa-y-descubrimiento-636.html
- Universitat de Valencia (2024). Joseph John Thomson. Recuperado el 8 de abril de 2024, de: https://www.uv.es/bertomeu/material/museo/atomo/Thom..htm
- Herradón, B. (2015) Descubrimiento del electrón. Recuperado el 8 de abril de 2024, de: https://principia.io/2015/04/30/descubrimiento-del-electron.IjEyMiI/