El Subcomité de Evaluación de Productos Biotecnológicos (SEPB) es un grupo multidisciplinario de especialistas, responsables de la evaluación previa de la información técnica y científica presentada para las solicitudes de Modificación, Prórroga y Registro Sanitario de Medicamentos Biotecnológicos Innovadores y Biocomparables para determinar si existen elementos para demostrar la calidad, seguridad y eficacia
PROCEDIMIENTO DE ATENCIÓN DE SOLICITUDES
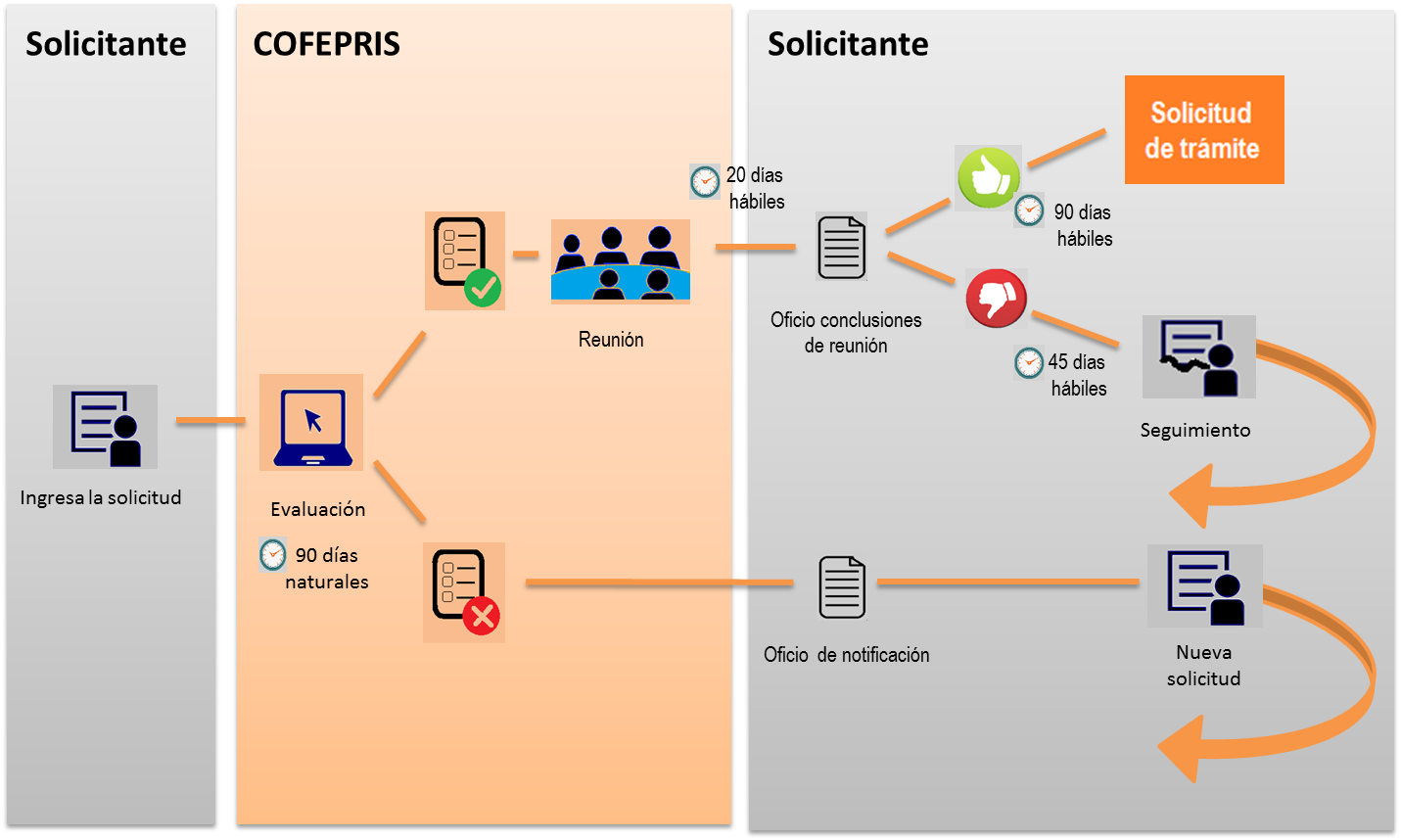
GENERALIDADES
TIPO DE PRODUCTO
El medicamento biotecnológico en evaluación se presentará como producto en desarrollo o producto terminado, de acuerdo a lo siguiente:
Producto en desarrollo: Son aquellos medicamentos que se encuentran en etapa de investigación y desarrollo, y solo pueden ser evaluados por el SEPB. Las recomendaciones vertidas en las reuniones con el SEPB, en la modalidad de producto en desarrollo son independientes de la evaluación como producto terminado, por lo que al concluir la etapa de desarrollo, deberá dar cumplimiento a las reuniones correspondientes como producto terminado.
Producto terminado: Son aquellos medicamentos que cuentan con sus etapas de investigación y desarrollo concluidas, relacionadas con solicitudes de Prórroga, Modificación y Registro Sanitario de Medicamentos Biotecnológicos. Las opiniones vertidas en las reuniones con el SEPB y/o CMN no son vinculatorias para la autorización de los trámites.
MODALIDADES DE REUNIÓN PARA PRODUCTO TERMINADO
Los medicamentos biotecnológicos son evaluados en diferentes modalidades de reunión, como se describen a continuación:
a) Reunión ante el Subcomité de Evaluación de Productos Biotecnológicos y posteriormente reunión ante el Comité de Moléculas Nuevas
| Tipo de trámite | Descripción |
| Registro sanitario |
|
b) Reunión conjunta ante el Subcomité de Evaluación de Productos Biotecnológicos y Comité de Moléculas Nuevas
| Tipo de trámite | Descripción |
| Registro sanitario |
|
|
Modificaciones a las condiciones de registro sanitario |
|
* Agencias reconocidas por la COFEPRIS: son aquellas Autoridades sanitarias extranjeras con las que se tiene acuerdos de equivalencia.
** A consideración de la Secretaria, dependiendo de la modificación pueden ser evaluados en la modalidad a)
c) Reunión ante el Subcomité de Evaluación de Productos Biotecnológicos
| Tipo de trámite | Descripción |
| Prórroga de registro sanitario | Aquellas mencionadas en el numeral 5.1.4 y en el Único Transitorio de la NOM-257- SSA1-2014, En materia de medicamentos biotecnológicos |
La solicitud de reunión se debe ingresar a través del Centro Integral de Servicios con homoclave EL48, la cual debe contener únicamente lo siguiente:
- Formato de solicitud de reunión ante el CMN y sus subcomités: Se entregará impreso y en electrónico, proporcionando todos los datos solicitados.
- Información para evaluación en electrónico: Se entregará únicamente en USB, de acuerdo a lo señalado en los “Requisitos para presentar la información en electrónico”.
En caso de requerir el "Formato de solicitud" en archivo editable, puede solicitarlo al correo: sepb@cofepris.gob.mx
PARTICULARIDADES PARA LA REUNIÓN
LOGISTICA DE LA REUNIÓN
- Dos días antes de la reunión deberá enviar por correo electrónico el nombre de las personas que asistirán a la reunión indicando la actividad que realizarán y la presentación en archivo PDF al correo electrónico sepb@cofepris.gob.mx y nochoa@cofepris.gob.mx.
- El día de la reunión, se entregará una carpeta engargolada o un fólder con broche a cada uno de los miembros invitados (veinticinco carpetas), ésta debe contener la presentación impresa y el proyecto de Información para Prescribir del producto.
- La reunión se llevará a cabo de acuerdo a lo siguiente:
Reuniones ante el SEPB
| Actividad | Duración | Responsables |
|---|---|---|
| Inicio | 15 min | Todos |
| Presentación | 60 min | Laboratorio |
| Discusión | 30 min | SEPB |
| Conclusiones | 15 min | Todos |
Reuniones conjuntas (SEPB/CMN) - Registro sanitario
| Actividad | Duración | Responsables |
|---|---|---|
| Inicio | 15 min | Todos |
| Presentacion | 90 min | Laboratorio |
| Preguntas | 30 min | Laboratorio - SEPB/CMN |
| Discusión | 30 min | SEPB/CMN |
| Conclusiones | 15 min | Todos |
Reuniones conjuntas (SEPB/CMN) - Modificaciones
| Actividad | Duración | Responsables |
|---|---|---|
| Inicio | 15 min | Todos |
| Presentación | 60 min | Laboratorio |
| Discusión | 30 min | SEPB/CMN |
| Conclusiones | 15 min | Todos |
- Se permitirá el acceso de máximo 10 personas que representen a su empresa, cuyos integrantes deben ser entre los expertos en la molécula y el personal administrativo legal.
- La empresa deberá contar con el equipo y material que se requiera para la presentación; proyectores, computadoras personales, control para diapositivas, indicadores o señaladores y micrófonos. Si se requiere de traducción simultánea, estará a cargo de la empresa y deberá contar con al menos 25 receptores para todos los miembros invitados y funcionarios de esta Comisión Federal. Se les pide estar a primera hora en la sede para la instalación del equipo y se colocará bajo las indicaciones del personal de la COFEPRIS.
- El acceso al estacionamiento se permitirá únicamente a los vehículos pertenecientes al audio y alimentos (cuando aplique).
- Para cualquier duda o contratiempo relacionado con la logística, se tratará directamente con la. Lic. Nashelli Ochoa Feltrin, Tel: 50805200 ext. Ext: 1011, correo electrónico: nochoa@cofepris.gob.mx
RECOMENDACIONES PARA LA PRESENTACIÓN
- La información presentada el día de la reunión, deberá corresponder con la ingresada en la solicitud de reunión.
- No se podrán exponer otros productos que no sean motivo de la reunión.
- No es necesario incluir datos de la empresa, ni Curriculum de los ponentes
- Los temas que se abordarán en la reunión dependerán de la modalidad de reunión
Reunión ante el SEPB
Temas
- Datos de la solicitud
- Datos del producto
- Estatus regulatorio
- Calidad
- Estudios preclínicos
- Estudios clínicos
- Conclusiones
Reunión conjuntas (SEPB/CMN)
Temas
- Datos de la solicitud
- Datos del producto
- Estatus regulatorio
- Calidad
- Estudios preclínicos
- Estudios clínicos
- Extrapolación (cuando aplique)
- Farmacovigilancia
- Conclusiones
REGLAS DE CONDUCTA DURANTE LAS REUNIONES
Para poder llevar a cabo la reunión en un ambiente agradable y cómodo, al asistir a una reunión con el SEPB, debe considerar lo siguiente:
- Presentarse de manera puntual a la hora indicada. La puntualidad es un hábito que dice mucho de nuestra disciplina y del valor que damos a la actividad, sino también del respeto y consideración que debemos a los demás.
-
Apague su celular o póngalo en modo de silencio. Evite contestar llamadas o mensajes a menos que sea indispensable.
-
Escuche en silencio, con atención y sin interrupciones a la persona que expone, muestre una actitud disciplinada en el transcurso de la actividad.
-
Pida la palabra de modo discreto, cuando requiera realizar una pregunta o comentario. No comience hablar sin que el auditorio esté preparado para atenderlo.
-
Respete el orden concedido para opinar, evite atropellos a los comentarios de lo demás, una conversación a la vez.
-
Cuide el tono y volumen de voz al expresarse. Desafié las ideas, no a las personas.
-
No se permite grabar la reunión, ni divulgar o publicar por ningún medio: comentarios, opiniones técnicas o científicas así como las conclusiones que se hayan emitido durante la reunión
Si viola las presentes pautas, sus acciones podrán resultar en la suspensión o prohibición permanente de su participación en las reuniones.
El SEPB se reúne una vez por semana los días jueves, sin embargo las reuniones no están abiertas al público. A continuación se muestra la programación mensual y las resoluciones disponibles
Programación mensual
| Enero | Febrero | Marzo | Abril |
| Mayo | Junio | Julio | Agosto |
| Septiembre | Octubre | Noviembre | Diciembre |
Resoluciones disponibles
| 2017 | 26 de enero al 07 de diciembre |
| 2016 | 21 de enero al 08 de diciembre |
| 2015 | 22 de enero al 26 de noviembre |
| 2014 | 22 de agosto al 11 de diciembre |
| Comisión Federal para la Protección contra Riesgos Sanitarios |
| Secretario técnico |
| Mariana Iliana Ruiz Zarate |
| Directora Ejecutiva de autorizacion de Productos y Establecimientos |
| Suplente |
| Adriana Martínez Martínez |
| Subdirectora Ejecutiva de Fármacos y Medicamentos |
| Academia Nacional de Medicina |
| Dr. Jorge Eduardo Herrera Abarca |
| Academia Nacional Mexicana de Bioética, A.C. |
| Dr. Eusebio Enrique Mendoza Carrera |
| Comisión Federal para la Protección contra Riesgos Sanitarios |
| Dr. Augusto Bondani Guasti |
| Consejo de Salubridad General |
| IQI. Antonio Muñoz Ariza |
| Farmacopea de los Estados Unidos Mexicanos |
| Q.F.B. Luis Antonio Montesinos Santiago |
| Instituto de Seguridad y Servicios Sociales para los Trabajadores del Estado |
| Dra. María Eugenia Vargas Camaño |
| Instituto Nacional de Medicina Genómica |
| Dr. Juan Pablo Reyes Grajeda |
| Suplente |
| Dr. Sergio Agustín Román Gonzalez |
| Instituto Politécnico Nacional |
| Dra. Sonia Mayra Pérez Tapia |
| Suplente |
| Dra. Alejandra Verónica Tenorio Calvo |
| Universidad Autónoma de Nuevo León |
| Dra. Lourdes Garza Ocañas |
| Universidad Nacional Autónoma de México- Facultad de Medicina |
| Dra. María del Carmen Jiménez Martínez |
| Universidad Nacional Autónoma de México - Facultad de Química |
| Dra. Helgi Helene Jung Cook |
| Universidad Nacional Autónoma de México- Instituto de Investigaciones Biomédicas |
| Dr. Mauricio Alberto Trujillo Roldán |
| Universidad Nacional Autónoma de México- Instituto de Biotecnología |
| Dra. Laura Palomares Aguilera |
| Suplente |
| Dr. Ricardo Martin Castro Acosta |